Дмитрий Жарков
«Наука из первых рук» №4(75), 2017
Управлять активностью генов вполне реально. Инженерия живых систем получила в свое распоряжение новый мощный инструмент.
Кроме обычного текста ДНК, записываемого четырьмя буквами А, Г, Т и Ц, наш геном содержит множество инструкций, каким образом этот текст читать, чтобы получилось что-то осмысленное. Сейчас исследователи не только понимают механизм записи этих инструкций, но и изобретают способы их перезаписи для регуляции клеточных процессов.
Ясамыхчестныхправилкогданевшуткузанемогонуважатьсебязаста-вилилучшевыдуматьнемогегопримердругимнауканобожемойкакаяскукасбольнымсид-етьиденьиночьнеотходянишагупрочькакоениз...
Конечно, каждый ходивший на школьные уроки литературы, узнает в этой длинной последовательности букв начало «Евгения Онегина». Но, боже мой, какой нелегкой была бы задача прочитать весь пушкинский роман без пробелов, точек и запятых, разбиения на строки и строфы! А если нужно не просто прочитать, а прочитать вслух и с выражением? И не знакомый со школы текст, а совершенно новый? А если стоит задача найти в этом тексте рифмы или определить стихотворный размер?
Здесь играть, здесь не играть, здесь рыбу заворачивали
Первые виды письменности в истории примерно так и выглядели. Несколько тысяч лет потребовалось людям, чтобы дойти до современных, привычных нам видов оформления речи на письме. И это еще не самая сложная ситуация, когда записанный текст требует пояснений для правильного чтения. Кто хоть сколько-нибудь времени посвятил изучению нотной грамоты, помнит диезы и бемоли, крещендо и диминуэндо и массу других специальных знаков, без которых записанные ноты невозможно сыграть так, чтобы получился Вивальди или Моцарт. «Здесь играть, здесь не играть, здесь рыбу заворачивали» — пересмотрите замечательную миниатюру В. Винокура и Л. Оганезова, там это очень хорошо объяснено.
Все сказанное имеет самое непосредственное отношение и к биологии. В каждой клетке тела находится длинный «текст» ДНК, состоящий примерно из 6 млрд чередующихся «букв» А, Г, Т и Ц. В этом тексте записаны все инструкции по построению любой клетки организма. Так почему же, если текст везде одинаковый, в мозге по его инструкциям получаются нейроны, в печени — гепатоциты, а некоторые незаконопослушные клетки ухитряются стать патологическими?
Ответ на поставленный вопрос краток и очень сложен. В каждой клетке, помимо текста ДНК, есть инструкции, как этот текст читать. Они могут быть записаны и в самой ДНК, и в белках, которые с ней связываются в клеточном ядре. А вот как эти инструкции работают — проблема настолько обширная и малопонятная, что в современной биологии считается одной из главных. Если последовательностями из четырех букв занимаются традиционная и молекулярная генетика, то инструкции — предмет отдельной дисциплины, эпигенетики, или «окологенетики», если частично перевести с греческого.
То, что мы сейчас знаем о наследовании генов и признаков организмов, во многом является следствием революции в молекулярной биологии, которая произошла в середине XX в. благодаря трудам Дж. Уотсона, Ф. Крика и десятков их коллег, чьи портреты украшают ныне учебники и сайт Нобелевской премии. Уже в то время стало ясно, что даже наследуемые признаки не всегда полностью определяются последовательностью нуклеотидов ДНК в геноме клетки или организма.
Например, в 50-х гг. прошлого века канадский генетик А. Бринк, работая с кукурузой, открыл явление, которое назвал парамутацией. Он брал растения с двумя разными аллелями гена red1, отвечающего за синтез пигмента и придающего зернам красную окраску. Один из этих аллелей дает темно-красные зерна, другой — более светлые. Побывав вместе со светло-красным аллелем в одном растении, темно-красный тоже становился светлым, не меняя при этом, однако, своей нуклеотидной последовательности. В итоге этих и многих других экспериментов возникло понятие о существовании двух взаимодополняющих систем наследственности: генетической, которая основана на последовательности нуклеотидов, и эпигенетической, основанной на стабильной активации и инактивации генов.
Парадоксально, но, несмотря на огромное и все возрастающее число публикаций, посвященных эпигенетике (база данных PubMed на момент написания статьи насчитывала 64898), единое определение этого понятия отсутствует. Некоторые ученые вслед за английским генетиком и эмбриологом К. Уоддингтоном понимают под эпигенетикой все, что происходит в организме при «реализации» генотипа — его проявлении во внешних признаках (фенотипе) в конкретных условиях среды. Другие специалисты, опираясь на авторитет не менее известных генетиков А. Риггса, Р. Холлидея и Дж. Мэйнард-Смита, более узко трактуют эпигенетику как наследование признаков, не связанных с различиями в последовательности ДНК. В любом случае до недавнего времени считалось, что эпигенетические механизмы отвечают за передачу информации дочерним клеткам о состоянии материнской клетки при ее делении, но лишь в исключительных случаях они задействованы в передаче информации из поколения в поколение у многоклеточных организмов.
Хороший, плохой, нейтральный
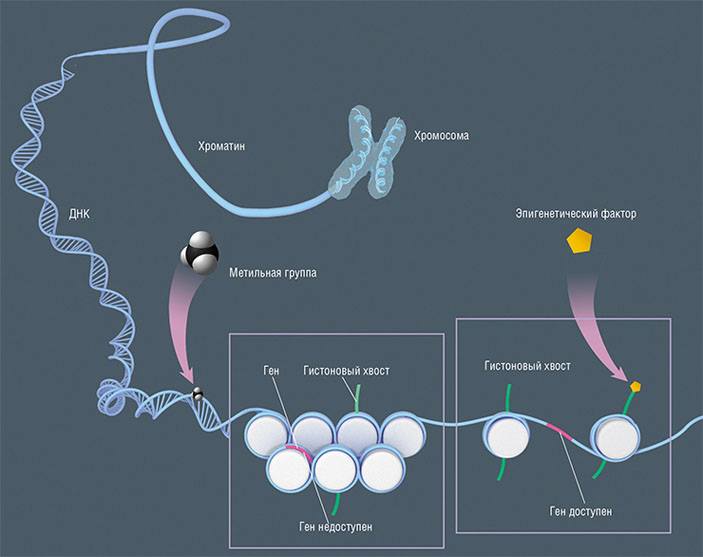
Сейчас известны два основных способа эпигенетической регуляции активности генов у животных и растений. Один из них основан на внесении модификаций в белки гистоны, образующие нуклеосомы — «катушки», на которые намотана ДНК в ядре клетки. Чем плотнее упакованы ДНК-белковые катушки в так называемый хроматин, тем меньше доступ к ДНК для ферментов, ведущих транскрипцию — синтез РНК по матрице ДНК. А чем меньше РНК — тем меньше белка производится, меньше активность гена.
Второй же способ основан на использовании особого основания ДНК — 5-метилцитозина. От обычного цитозина он отличается наличием дополнительной метильной группы, чем становится несколько более похож на тимин — одно из обычных оснований ДНК. Но такие метилированные цитозины могут возникать не где угодно, а только если вслед за цитозином сразу стоит гуанин. Такие последовательности называются CpG-динуклеотидами. Если их в ДНК соберется много и близко друг к другу — получаются CpG-островки, чаще всего встречающиеся в районах промоторов — участков генов, с которых начинается их «чтение», т. е. транскрипция.
Эпигенетическая регуляция активности генов
Известно два способа эпигенетической регуляции активности генов. Один из них основан на внесении модификаций в белки гистоны, на которые, как на катушку, намотана ДНК в ядре клетки. Чем плотнее упаковка в катушке, тем ДНК менее доступна для ферментов, синтезирующих РНК с матрицы ДНК, т. е. гены в области плотной упаковки будут неактивны. Эпигенетическая модификация гистонов может способствовать более свободному расположению «катушек», в результате чего ферменты получают доступ к этому участку ДНК, и РНК, а затем и белок, закодированный в генах, могут синтезироваться. Другой способ эпигенетической регуляции — метилирование, присоединение к ДНК метильной группы, в результате чего азотистое основание цитозин превращается в 5-метилцитозин. Наличие метильной группы, так же как и модификация гистонов, в итоге меняет плотность упаковки ДНК и доступность генов для ферментов
Обычно в нормальных клетках большинство CpG-динуклеотидов в геноме человека метилировано, а вот в островках, напротив, метилцитозин встречается редко. Зато во многих раковых клетках это распределение нарушено: островки больше метилированы, а остальные CpG-динуклеотиды — меньше. На самом деле метилцитозина в клетках так много, что иногда его даже называют «пятым основанием ДНК».
Каким же образом наличие 5-метилцитозина в ДНК влияет на активность генов? Своими кодирующими свойствами он от обычного цитозина ничем не отличается и прекрасно «прочитывается» при транскрипции. Зато метилцитозины, а точнее метилированные CpG-динуклеотиды, узнаются белками, содержащими так называемые метилсвязывающие домены (участки). После связывания с метилированной ДНК они привлекают другие белки, которые более плотно упаковывают хроматин, а это, как уже говорилось, мешает транскрипции.
До недавнего времени в этом механизме все казалось более-менее понятно: цитозин — «хороший», способствует активности генов, метилцитозин — «плохой», ее подавляет. Но такие простые сценарии природе, как правило, не нравятся. Недавно была обнаружена «шестая буква» ДНК — 5-гидроксиметилцитозин, об истории открытия которого мы поговорим чуть позже. К метильной группе у него добавлена еще гидроксильная, и это сильно отличает его от метилцитозина с точки зрения клетки: он узнается не теми же белками, что метилцитозин, а совершенно другими, которые не конденсируют хроматин, а, наоборот, делают его менее плотным. Так что в качестве «супермена» для повышения активности генов выступает именно гидроксиметилцитозин, а простой цитозин держит нейтралитет в этой вечной битве.
Пишем, стираем, пишем, стираем, пишем...
Любой сигнал на то и сигнал, что его можно включить и выключить, подать и отменить. Разумеется, если существуют специальные основания ДНК, меняющие активность генов, то один из главных вопросов — откуда они в ДНК появляются и куда потом пропадают?
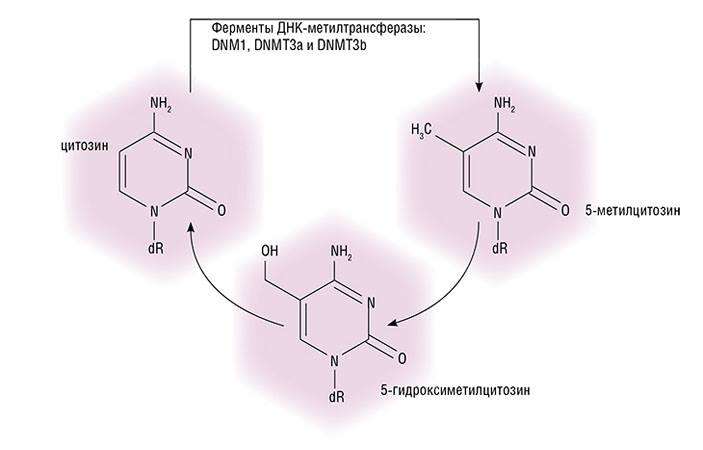
Специальные ферменты ДНК-метилтрансферазы (метилазы) DNMT1, DNMT3a и DNMT3b узнают CpG-динуклеотиды, последовательно стоящие цитозин и гуанин, и снабжают их метильной группой.
Специальные ферменты ДНК-метилтрансферазы (метилазы) DNMT1, DNMT3a и DNMT3b узнают CpG-динуклеотиды, последовательно стоящие цитозин и гуанин, и снабжают их метильной группой. В результате образуется подавляющий активность генов 5-метилцитозин. Далее это основание может с помощью белков ТЕТ превратиться в 5-гидроксиметилцитозин, наоборот, способствующий активации генов. И, наконец, в процессе дальнейших превращений, тоже опосредованных клеточными ферментами, основание может вновь превратиться в обычный цитозин
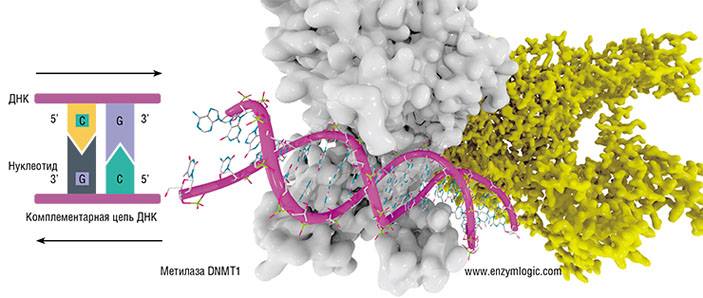
С метилцитозином все стало понятно достаточно давно. Еще лет тридцать назад в клетках были обнаружены ферменты ДНК-метилтрансферазы, или метилазы, которых сейчас известно три — DNMT1, DNMT3a и DNMT3b. Они узнают CpG-динуклеотиды и снабжают их метильной группой. Три фермента играют немного разные роли. DNMT1 — «поддерживающая» метилаза. Если присмотреться, CpG-динуклеотид относится к палиндромным последовательностям, читающимся одинаково в обоих направлениях по комплементарным цепям. Поэтому метилцитозинов там не один, а два, и после репликации — копирования ДНК при делении клетки — нужно опять метилировать свеженький, только что встроенный в новую цепь ДНК цитозин, чем и занимается метилаза DNMT1. В отличие от последней, DNMT3a и DNMT3b могут метилировать ДНК «с нуля», даже если в ней еще нет метилцитозина. Внимательный читатель может спросить: а где же DNMT2? Есть такой белок, только он метилирует не ДНК, а РНК, и мы о нем говорить не будем.
CpG-динуклеотид относится к палиндромным последовательностям
CpG-динуклеотид относится к палиндромным последовательностям: он читается одинаково в обоих направлениях по комплементарным цепям ДНК. Одиночная нить ДНК представляет собой полимер — «бусы», состоящие из 4-х видов бусинок-нуклеотидов: аденина (A), тимина (T), гуанина (G) и цитозина (C). Две нити ДНК удерживаются вместе за счет взаимодействий между парами нуклеотидов, подходящих друг другу, как ключ к замку: A — к T, G — к C. Метилцитозинов, таким образом, в CpG-динуклеотиде два, и после репликации (удвоения) ДНК в процессе деления клетки «новый» нужно опять метилировать. Этим занимается метилаза DNMT1
Знакомство с белками, метилирующими ДНК, мы закончим упоминанием о том, что они существуют и у бактерий. Эпигенетической регуляции с участием 5-метилцитозина бактерии не изобрели, зато у них есть так называемые системы рестрикции-модификации, которые защищают их от вирусов. В бактериальной клетке, как правило, имеются ферменты-рестриктазы, разрезающие ДНК по определенным последовательностям, и метилазы, узнающие и метилирующие эти последовательности. Если в клетку попадает вирус, его ДНК разрезается, а бактериальная ДНК от этого защищена метилированием.
Разнообразие способов узнавания последовательностей и видов метилирования в мире бактерий велико, но некоторые из микроорганизмов, например спироплазма (симбиотический микроб, живущий в кишечнике насекомых), используют именно 5-метилцитозин в CpG-динуклеотидах. За это их очень любят ученые, поскольку в экспериментальных целях метилазу M.SssI из спироплазмы использовать не в пример легче, чем человеческие белки.
История со стиранием эпигенетических меток гораздо более запутанная. Долгое время полагалось, что клетка вообще этого не делает, а просто прекращает поддерживающее метилирование в каком-то месте генома, и через несколько клеточных делений большая часть потомков клетки не будет содержать метилцитозин в этом месте. Однако многие клетки в организме человека не делятся вообще, а убирать метильные метки способны. В других же случаях метилцитозин убирается из ДНК гораздо быстрее, чем позволяет клеточное деление. Поэтому когда наконец открыли систему активного деметилирования, все причастные к эпигенетике исследователи облегченно вздохнули. А механизм оказался крайне интересным.
Сами ломаем, сами чиним
О системе репарации ДНК писали неоднократно. Эта система помогает нам выживать, несмотря на десятки тысяч повреждений ДНК, которые каждая клетка нашего организма испытывает ежедневно как под влиянием внешних причин (ультрафиолетовые солнечные лучи, радиация, поступающие в организм токсины), так и за счет неизбежных биохимических процессов (главные «злодеи» тут — кислород и вода).
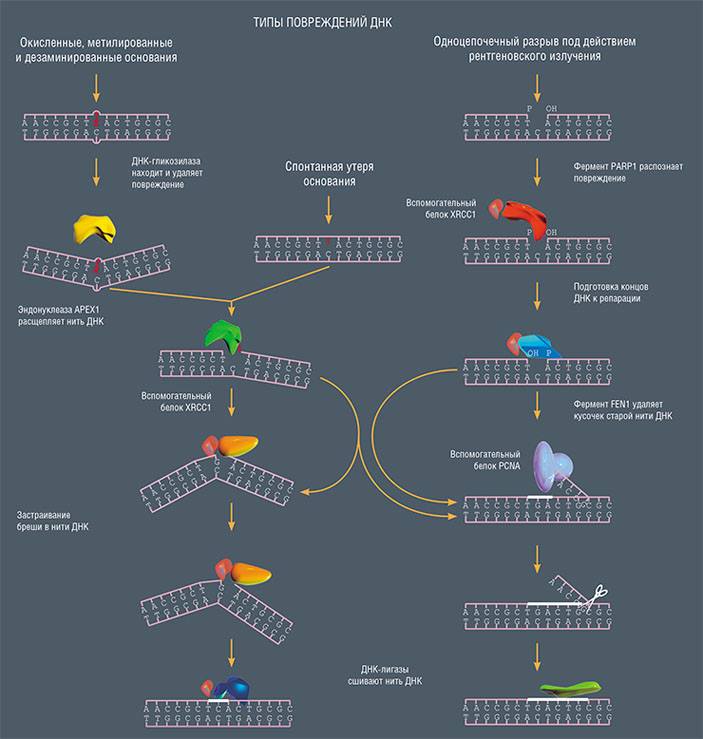
Самый важный из путей репарации, эксцизионная репарация оснований, начинается с того, что поврежденное основание узнается и вырезается из ДНК одним из ферментов, относящихся к классу ДНК-гликозилаз. Далее последовательно действуют еще несколько белков, и в результате на место поврежденной «буквы» ДНК встает нормальная.
Схема эксцизионной репарации азотистых оснований белковыми комплексами, специализирующимися на «мелком» ремонте небольших повреждений оснований ДНК, не сопровождающихся значительным искажением двойной спирали. Такой конвейер ферментов репарации не только исправляет спонтанные повреждения, но и идеально приспособлен для того, чтобы удалять из ДНК какие угодно модифицированные основания. По: (Ходырева, Лаврик, 2007)
Обычно про репарацию вспоминают именно в контексте борьбы с повреждениями ДНК, мутациями и раком. Однако несложно заметить, что такой конвейер ферментов идеально приспособлен для того, чтобы удалять из ДНК какие угодно модифицированные основания, а не только спонтанные повреждения. Инженер, перед которым была бы поставлена задача изобрести систему, удаляющую из ДНК метилцитозин, долго бы не думал: конечно, нужно сконструировать ДНК-гликозилазу, его вырезающую, а дальше репарация сама заделает дырку обычным цитозином. И инженер был бы не совсем неправ: именно по такому пути пошли растения, у которых тоже есть эпигенетическая система, использующая 5-метилцитозин.
Но у животных все организовано сложнее, и это лишний раз напоминает нам о различиях между инженером, активно использующим имеющуюся на плечах голову, и эволюцией, работающей по принципу «получилось бы хоть как-нибудь, а потом само усовершенствуется». Сначала метильная группа 5-метилцитозина окисляется одним из белков TET (их у человека три). При этом получается тот самый 5-гидроксиметилцитозин, который активирует гены. Если нам надо переключить ген из неактивного состояния в активное, мы достигли цели. А если нужно восстановить нейтральное состояние с цитозином, то ту же метильную группу можно окислить еще в два шага с образованием 5-формилцитозина и 5-карбоксилцитозина. Последние уже не активирующие и не ингибирующие и воспринимаются системой репарации как повреждения, которые она исправляет, в результате чего образуется цитозин. Заодно можно удалить аминогруппу бывшего метилцитозина и поменять ее на кетогруппу (проще — на атом кислорода). Этим занимаются несколько специальных ферментов-дезаминаз, и это тоже повреждение, которое удалит система репарации.
Можно сказать, что последние исследования в области эпигенетики изменили наш взгляд на ДНК. Школьная картина с четырьмя буквами сейчас представляется очень упрощенной: клетка для регуляции активности генов постоянно активно заменяет многие из этих букв на другие, не входящие в этот короткий алфавит. Уже сейчас ясно, что метилцитозином и гидрокисметилцитозином дело не ограничивается, и известны примеры, когда основания, ранее считавшиеся повреждениями, выполняют полезную функцию. Например, клетки нашей иммунной системы активно повреждают гены, кодирующие антитела — это помогает им быстро мутировать и перебирать много вариантов антител в поисках тех, которые будут узнавать вторгающиеся в наш организм патогены. Иногда специально поломать, а потом починить — очень эффективная стратегия замены старого на новое.
Подкрутить в нужном месте
Итак, мы знаем, как клетки ставят в ДНК и стирают из нее эпигенетические метки. Можем ли мы использовать это в своих интересах? Выключить активный онкоген в раковых клетках или, наоборот, подтолкнуть нужный неработающий ген?
Главный вопрос тут: как нацелить в нужное место генома белок, вводящий или стирающий эпигенетические модификации? И как раз в области такого нацеливания в последние годы произошла еще одна революция в биологии, которая сулит настолько большие перспективы в инженерии живых организмов, что сравнить ее можно, пожалуй, только с созданием ньютоновской механики, позволяющей инженерам проектировать прочные мосты и нетонущие корабли. Наш журнал писал и об этих достижениях, объединенных общим названием «геномное редактирование» (Власов, Пышный, Жарков, 2014, Медведев, 2014; Закиян, Власов, Медведев, 2014;), поэтому за деталями читателя мы отсылаем к этим статьям, а здесь упомянем только самое главное.
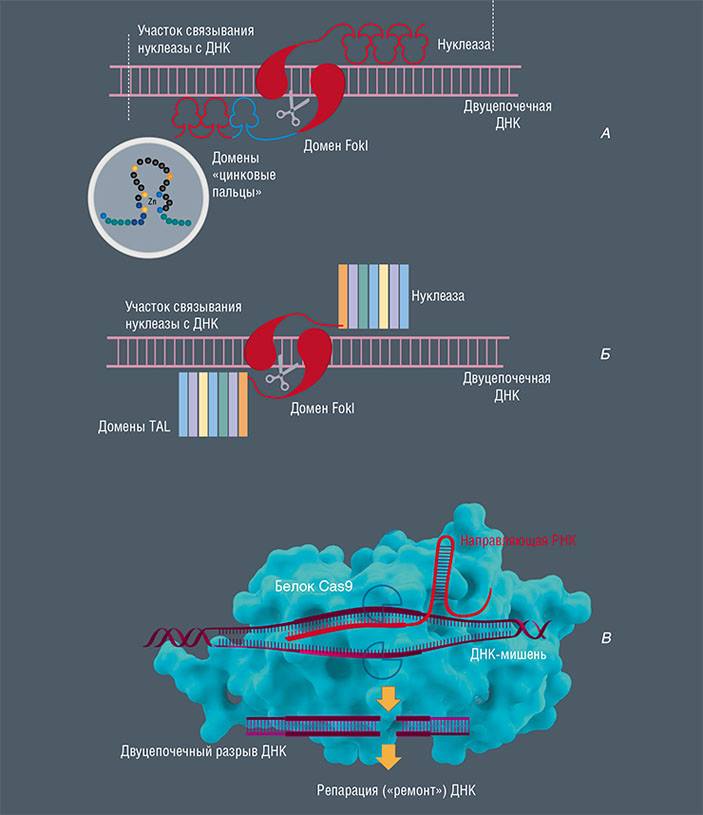
Сейчас существуют три главные системы нацеливания на нужное место в геноме. Одна основана на цинковых пальцах, широко распространенных белковых мотивах, узнающих небольшие кусочки ДНК. Комбинируя несколько «пальцев» с разными специфичными последовательностями ДНК, можно точно адресовать снабженный ими белок в уникальное место в геноме. По сходному принципу работает и так называемая система TAL-эффекторов, взятая из бактерий Xanthomonas, вызывающих многие болезни растений: небольшие участки белка, узнающие одну пару оснований, комбинируют для нацеливания на конкретную последовательность ДНК. Наконец, самая популярная на сегодня система, CRISPR/Cas9, для адресации использует последовательность РНК, соответствующую нужному участку ДНК. Если мы хотим нацелить РНК или белок ее на конкретный участок генома, мы делаем искусственный белок, в котором сочетается адресующий модуль, сконструированный на основе одной из упомянутых систем, и активный модуль, который будет, например, метилировать или деметилировать ДНК.
В настоящее время существует три главные системы нацеливания на нужное место в геноме для его редактирования. Первая основана на белковых модулях «цинковые пальцы» фермента zinc-finger (А). Каждый «цинковый палец» этой нуклеазы способен «узнать» и специфично связаться с определенной последовательностью ДНК из трех нуклеотидов. Вторая, похожая система основана на белках TAL-эффекторы (Б). Каждый из белковых доменов TAL узнает один нуклеотид ДНК. Обе нуклеазы для «разрезания» ДНК используют нуклеазный домен FokI. Самая популярная система редактирования генома CRISPR/Cas9 (В) в качестве структур, узнающих ДНК, использует короткие РНК. Идея создания такой системы родилась при изучении механизмов, которые бактерии используют для защиты от своих патогенных вирусов (бактериофагов). Основой системы является комплекс из белка Cas9, способного разрезать нить ДНК, и направляющей РНК, которая может распознавать и связываться с определенным участком ДНК-мишени
Справедливости ради стоит сказать, что самые первые попытки адресно воздействовать на метилирование ДНК вообще обходились без белков. Еще в 1990-х гг. в клетки научились вводить олигонуклеотиды — небольшие кусочки ДНК, содержащие метилцитозин в нужном месте, с расчетом на то, что они будут связываться с комплементарной ДНК, а система метилирования с помощью фермента DNMT1 примет это за последствия репликации и вставит в нужном месте ДНК метилцитозин. Это даже получалось, но в целом эффективность процесса была крайне низкой. В 1997 г. ученые наконец нашли первый подход к системам современного вида. В лаборатории Т. Бестора в Колумбийском университете (США) слили вместе адресующий модуль из цинковых пальцев и активный модуль в лице вышеупомянутой бактериальной метилазы M.SssI. Полученная конструкция в пробирке прекрасно метилировала ДНК в нужном месте. В 2003 г. М. Кладде из Техасского университета (США) сделал следующий шаг, испытав аналогичные адресованные гибридные метилазы в живых клетках, а именно в дрожжах, которые своей системы метилирования не имеют
До появления систем адресации исследователи пытались как-то иначе с пользой изменять глобальный статус метилирования генома клеток человека и достигли на этом пути определенных успехов. В клинической онкологии для борьбы с лейкозами применяются лекарства азацитидин и децитабин — это аналоги цитозина, которые не могут быть метилированы, и в злокачественных клетках активируются убивающие их гены. Аналогичные подходы, только с другими лекарствами, используются при лечении серповидноклеточной анемии — заболевания, при котором мутирована одна из белковых цепей гемоглобина. При глобальном деметилировании запускаются гены фетальных глобинов. В норме у взрослого они уже работать не должны, но их активация помогает больному иметь хоть какой-то функциональный гемоглобин.
После того, как была показана принципиальная возможность нацеленного редактирования эпигенетических меток, новые варианты, использующие всевозможные адресующие и активные модули, посыпались как из ведра. Сейчас с помощью современных систем редактирования генома испытаны практически все известные ферменты систем метилирования и деметилирования. Но остается вопрос: а нужно ли это? Какое значение для клетки может иметь изменение метилирования в одном конкретном месте? Не окажется ли так, что для надежного изменения эпигенетических меток, регулирующих один ген, мы должны будем вводить в клетку десятки и сотни белков с разными адресами?
Пока кажется, что ответы на эти вопросы вполне оптимистичны. Еще эксперименты Кладде показали, что в дрожжах метилируется не только один конкретный участок, к которому адресована гибридная метилаза, но и CpG-динуклеотиды на несколько сотен нуклеотидов вокруг. В дальнейшем и другими группами ученых было показано, что и метилирование, и деметилирование как бы «расползаются» в стороны от места, куда было первоначально нацелено изменение. А в 2014 г., проанализировав огромное количество данных по метилированию и активности генов, международный консорциум, включающий и российских ученых, пришел к выводу о существовании того, что ученые назвали «светофорным метилированием»: примерно для 17% CpG-динуклеотидов есть зависимость активности гена от состояния метилирования одного конкретного CpG.
Так что, похоже, управлять активностью генов вполне реально. Инженерия живых систем получила в свое распоряжение новый мощный инструмент.
Литература
1. Власов В. В., Пышный Д. В., Жарков Д. О. Приручение древней молекулы // Наука из первых рук. 2014. Т. 57/58. № 3/4. С. 84–91.
2. Грин И. Р., Петрова Д. В., Жарков Д. О. Редактирование эпигенетических модификаций ДНК // Гены и клетки. 2016. Т. 11. № 2. С. 53–60.
3. Жарков Д. О. Загадки «ржавой» ДНК // Наука из первых рук. 2006. Т. 12. № 6. С. 24–35.
4. Жарков Д. О. Часовые генома // Наука из первых рук. 2009. Т. 28. № 4. C. 160–169.
5. Закиян С. М., Власов В. В., Медведев С. П. «Редакторы геномов». От «цинковых пальцев» до CRISPR // Наука из первых рук. 2014. Т. 56. № 2. С. 44–53.
6. Косова А. А., Ходырева С. Н., Лаврик О. И. ДНК на замке // Наука из первых рук. 2013. Т. 53/54. № 5/6. С. 14–21.
7. Медведев С. П. Как отредактировать наследственность // Наука из первых рук. 2014. Т. 55. № 1. С. 10–13.
8. Сидоренко В. С., Гроллман А., Жарков Д. О. Токсикологический детектив, или Дело балканской эндемичной нефропатии // Наука из первых рук. 2013. Т. 53/54. № 5/6. С. 22–33.
9. Ходырева С. Н., Лаврик О. И. Как клетка ремонтирует ДНК // Наука из первых рук. 2007. Т. 15. № 3. С. 82–89.
10. Goll M. G., Bestor T. H. Eukaryotic cytosine methyltransferases // Annu. Rev. Biochem. 2005. V. 74. P. 481–514.
11. Wu X., Zhang Y. TET-mediated active DNA demethylation: Mechanism, function and beyond // Nat. Rev. Genet. 2017. V. 18. N. 9. P. 517–534.
Жарков Дмитрий Олегович
Об авторе
Дмитрий Олегович Жарков — доктор биологических наук, заведующий лабораторией геномной и белковой инженерии Института химической биологии и фундаментальной медицины СО РАН (Новосибирск), заведующий лабораторией белковой инженерии Новосибирского государственного университета. Победитель конкурса Фонда содействия отечественной науке «Лучшие ученые РАН» 2004–2005 гг. Почетная грамота Президиума РАН за вклад в развитие производительных сил Сибири (2007 г.). Именная премия администрации Новосибирской области молодым ученым за научные достижения в области фундаментальных и прикладных исследований (2009 г.). Почетная грамота НГУ за многолетний добросовестный труд на благо университета (2014 г.). Почетный диплом РФФИ за большой вклад в развитие науки, многолетнюю плодотворную работу по поддержке фундаментальных научных исследований в экспертном совете РФФИ (2015 г.). Автор и соавтор 105 научных публикаций и 1 патента.
Источник: https://www.facebook.com/groups/1678002668913397/permalink/1794113313968998/ |